說(shuō)到細(xì)胞�����,我想大家應(yīng)該都不陌生���。我們最初了解細(xì)胞這個(gè)名詞應(yīng)該是在初中高中的生物課本上。我們也都知道���,我們的生命體都是由細(xì)胞這個(gè)微小的單位組成(病毒除外)。
作為一個(gè)科研狗,拿到一管細(xì)胞后我們想到更多的是:這是什么細(xì)胞(動(dòng)物的�?植物的?)���?原代細(xì)胞�?還是細(xì)胞系���?或者說(shuō),這細(xì)胞是貼壁生長(zhǎng)的����?還是懸浮生長(zhǎng)的?那么我們今天就來(lái)聊聊什么是原代細(xì)胞���。
原代細(xì)胞(primary cell):是指從機(jī)體的組織(如人組織�����、小鼠組織��、大鼠組織和兔組織等)經(jīng)蛋白酶或其它的方法獲得單個(gè)細(xì)胞并在體外進(jìn)行模擬機(jī)體培養(yǎng)的細(xì)胞����,稱為原代細(xì)胞。一般認(rèn)為����,培養(yǎng)的原代的第1代細(xì)胞和傳代到第10代以內(nèi)的細(xì)胞統(tǒng)稱為原代細(xì)胞培養(yǎng)。
在我們的科學(xué)研究過(guò)程中����,每個(gè)涉及到細(xì)胞研究的研究者都會(huì)根據(jù)自己的實(shí)驗(yàn)需求采用不同的細(xì)胞。根據(jù)自己的課題采用原代細(xì)胞或者細(xì)胞系�����,我們都知道��,細(xì)胞系的培養(yǎng)相對(duì)于原代細(xì)胞來(lái)說(shuō)更為的簡(jiǎn)單和易操作���,也不會(huì)擔(dān)心細(xì)胞在正常條件下會(huì)發(fā)生分化��、衰老等現(xiàn)象從而影響我們實(shí)驗(yàn)的可信性和重復(fù)性�。而原代細(xì)胞從獲取到培養(yǎng)整個(gè)過(guò)程要考慮的問(wèn)題則非常多,接下來(lái)我們就具體聊聊吧�����。
原代細(xì)胞的獲取���,就是從活體上將組織分解成單個(gè)細(xì)胞再進(jìn)行培養(yǎng)的過(guò)程,且整個(gè)過(guò)程要求無(wú)菌操作�����。具體要考慮的問(wèn)題有:組織分解的方式��,培養(yǎng)的時(shí)間��,換液時(shí)間�,細(xì)胞狀態(tài)判斷和凍存。
組織分解方式
將組織分解成單個(gè)細(xì)胞的方式目前主要有兩種:酶消化法和組織塊法(針對(duì)貼壁細(xì)胞)��。
膠原酶的選擇:(根據(jù)自己的組織樣本選擇合適的膠原酶是實(shí)驗(yàn)成功的大前提�����。)
膠原酶的配制:建議看相關(guān)的文獻(xiàn)進(jìn)行膠原酶的配制。小編常用的是DMEM進(jìn)行配制��,配制好的膠原酶消化液放置在37℃水浴鍋內(nèi)預(yù)熱(注意現(xiàn)用現(xiàn)配)�。
胰酶(酶聯(lián)合法獲取原代細(xì)胞中會(huì)加入胰酶,相關(guān)文章也蠻多的)
膠原酶消化時(shí)間:根據(jù)組織特性����,消化時(shí)間會(huì)有差異。以小鼠腎細(xì)胞為例��,加入膠原酶Ⅰ進(jìn)行消化后�����,放入37℃培養(yǎng)箱中消化45min~1h左右��,期間每隔10min中震蕩一次���,知道組織塊幾乎*消失為止(若是組織塊剪得非常細(xì)小,時(shí)間可以短一些���,30min左右即可)���。
培養(yǎng)過(guò)程:注意原代細(xì)胞在培養(yǎng)2天后可能會(huì)出現(xiàn)細(xì)胞液變黃(橘黃色)的現(xiàn)象,且無(wú)漂浮物,這是正?�,F(xiàn)象哦�����,不是污染��。這是由于細(xì)胞在貼壁生長(zhǎng)過(guò)程中釋放了CO2和其他物質(zhì)導(dǎo)致培養(yǎng)液PH發(fā)生了改變�����,所以變黃����。
取材:取組織中間部位,剪成大小均勻的小方塊(1~4mm2)�����,清洗干凈后轉(zhuǎn)移至培養(yǎng)皿中���,在培養(yǎng)皿中各組織塊要排列均勻�。
加液:培養(yǎng)液不能浸沒(méi)組織塊����,避免組織漂浮����。然后培養(yǎng)4h左右加培養(yǎng)液���,培養(yǎng)48h后換液���。
培養(yǎng)時(shí)間
無(wú)論是酶消化法還是組織塊法,取樣后培養(yǎng)時(shí)間最少需要一周以上的時(shí)間��,期間可換液或者傳代��。
換液時(shí)間
無(wú)論酶消化法還是組織塊法���,在培養(yǎng)期間需要隨時(shí)關(guān)注細(xì)胞的生長(zhǎng)狀況���,需觀察其是否貼壁��,是否污染��,組織塊法要觀察是否有細(xì)胞遷移出來(lái)�����。正常情況下48~72h可換液一次。
細(xì)胞狀態(tài)判斷
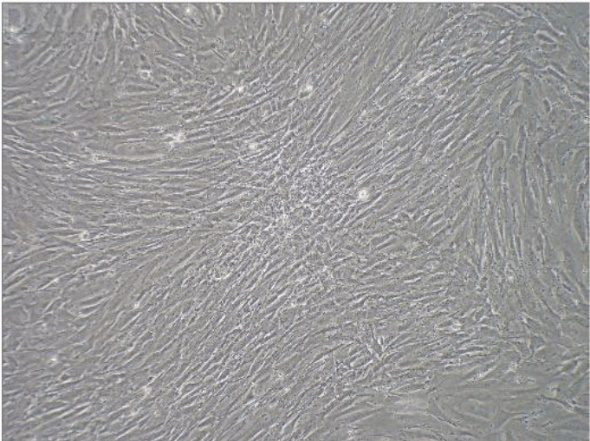
正常貼壁細(xì)胞在培養(yǎng)幾天后��,會(huì)逐漸貼滿整個(gè)瓶底或者皿底�,有的呈纖維狀,有的呈多邊形�。下圖均為比較健康的原代細(xì)胞圖(左:小鼠成纖維細(xì)胞;右:雞胚成纖維細(xì)胞�;下:人成纖維細(xì)胞)
這些細(xì)胞的狀態(tài)比較好,生長(zhǎng)至80%~90%融合就可以傳代啦���,傳代一次后的細(xì)胞會(huì)更干凈漂亮��。
凍存
傳一代后的細(xì)胞(也可以不傳代直接凍存)培養(yǎng)至80%~90%便可凍存起來(lái)供后續(xù)實(shí)驗(yàn)用�����。
凍存液配制:不同的細(xì)胞可能會(huì)有不同的凍存液配制方案��,各實(shí)驗(yàn)室也有自己的凍存方案����,常見(jiàn)的方案有:
C: 5%DMSO+45%DMEM+50%FBS (小編常用小鼠的���,鹿的都嘗試過(guò)����,細(xì)胞狀態(tài)OK)
原代細(xì)胞的培養(yǎng)其實(shí)與細(xì)胞系的培養(yǎng)無(wú)多大差別���,針對(duì)不同的細(xì)胞會(huì)選擇不同的細(xì)胞培養(yǎng)液�����。
1.培養(yǎng)液選擇:(根據(jù)不同的細(xì)胞類型和實(shí)驗(yàn)要求進(jìn)行培養(yǎng)液的選擇)
常用的L/H DMEM��,F(xiàn)12 DMEM��,RPMI 1640。
2.細(xì)胞培養(yǎng)過(guò)程無(wú)菌操作����。正常的復(fù)蘇����,換液和傳代操作,最后將培養(yǎng)好的細(xì)胞進(jìn)行相應(yīng)的實(shí)驗(yàn)即可
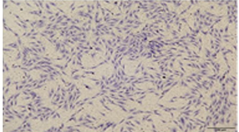
3.細(xì)胞鑒定����。有時(shí)候我們獲取的原代細(xì)胞可能會(huì)有不是自己期望的細(xì)胞在里面,或者獲取的不是我們的目標(biāo)細(xì)胞����。這個(gè)時(shí)候我們需要進(jìn)行細(xì)胞的鑒定。細(xì)胞鑒定需要購(gòu)買特定細(xì)胞的表面標(biāo)志物抗體或者染色試劑進(jìn)行鑒定�。如:
上圖左:為鹿茸間充質(zhì)層細(xì)胞,它可以被甲苯胺藍(lán)染色藍(lán)色�,胞質(zhì)胞核均被染成藍(lán)色。右:為鹿茸軟骨層細(xì)胞���,被甲苯胺藍(lán)染色后胞質(zhì)胞核均染成紫紅色����,因其內(nèi)部富含蛋白多糖���,可被異染成紫紅色���。
三、原代細(xì)胞試用的實(shí)驗(yàn)類型
前面我們了解了原代細(xì)胞獲取和培養(yǎng)過(guò)程中應(yīng)該注意的一些細(xì)節(jié)�����,這有助于我們培養(yǎng)我們的原代細(xì)胞���。那么原代細(xì)胞培養(yǎng)好后����,它可適用哪些研究呢?
原代細(xì)胞不僅廣泛應(yīng)用于分子���、細(xì)胞生物學(xué)和生物醫(yī)學(xué)基礎(chǔ)研究���,如蛋白質(zhì)組學(xué)、基因組學(xué)��、細(xì)胞株(系)研究�����、DNA����,RNA和遺傳學(xué)研究等,還可應(yīng)用于當(dāng)今熱門的生物醫(yī)藥產(chǎn)業(yè)如藥物篩選���、藥物代謝和毒理研究�����、癌癥藥物的研究等�����。在這些應(yīng)用中幾乎都涉及了幾個(gè)最常見(jiàn)的且最基礎(chǔ)的細(xì)胞實(shí)驗(yàn)�����,如下:
細(xì)胞增殖檢測(cè):
常見(jiàn)檢測(cè)方法:CCK8檢測(cè)法 ����,MTT檢測(cè)法�,Brdu檢測(cè)法,Edu檢測(cè)法��,平板克隆形成
細(xì)胞周期檢測(cè)
常見(jiàn)檢測(cè)方法:流式檢測(cè)細(xì)胞周期�,標(biāo)記有絲分裂百分率法
細(xì)胞凋亡檢測(cè)
常見(jiàn)檢測(cè)方法:流式檢測(cè)細(xì)胞凋亡,線粒體膜電位����,活性氧檢測(cè),Hoechst染色�����,電鏡,TUNEL
細(xì)胞轉(zhuǎn)移能力檢測(cè)
常見(jiàn)檢測(cè)方法:細(xì)胞劃痕實(shí)驗(yàn)��,Transwell實(shí)驗(yàn)�,Invasion實(shí)驗(yàn)

 更新時(shí)間:2021-08-10
更新時(shí)間:2021-08-10 點(diǎn)擊次數(shù):1399
點(diǎn)擊次數(shù):1399

 快速導(dǎo)航:
快速導(dǎo)航: 產(chǎn)品中心:
產(chǎn)品中心:
 公司地址
公司地址 關(guān)注公眾號(hào)
關(guān)注公眾號(hào)